1.目的
保障受试者人身安全和权益,做好临床试验的安全性管理工作。
2.适用范围
适用于临床试验中发生的不良事件(AE)、严重不良事件(SAE)和非预期事件。
3.规程
3.1 管理职责
3.1.1 本机构主要研究者总体负责临床试验项目AE、SAE和非预期事件的管理,有义务采取必要的措施以保障受试者的安全,并记录和报告。
3.1.2 机构办公室、伦理委员会和HRPP进行监督管理。
3.2 管理要点
3.2.1 研究者有义务采取必要的措施以保障受试者的安全,在临床试验过程中如发生AE、SAE和非预期事件,研究者应立即对受试者采取适当的措施,以保障受试者的安全。
3.2.2 研究者应及时记录,不得有任何隐瞒或虚报;同时向申办者、机构办公室、伦理委员会和HRPP报告。
3.2.3 研究者应对受试者在试验期间所发生的AE、SAE和非预期事件作出相应评估,判断与试验药物之间的关系,判断不良事件或非预期事件的严重程度。
3.2 需要报告的AE和非预期事件
(1)SAE;
(2)任何可能将受试者暴露在潜在风险之下的非预期事件;
(3)任何可能将受试者之外的人群(如研究者、研究者助理、公众等)暴露在潜在风险之下的非预期事件;
(4)额外信息提示研究的风险获益发生了改变。如研究的中期分析或安全委员会提示研究的风险获益发生了改变,或者其他的类似研究发表文献提示研究的风险获益发生了改变;
(5)违反了保密条款;
(6)为了解决受试者的紧急情况,而在伦理委员会审查同意之前就对方案做了修改;
(7)伤害了受试者或者存在潜在伤害风险的方案违背;
(8)申办方因为风险原因暂停试验。
3.3 报告时限
|
本中心发生的 |
报告时限 |
|
非预期事件(不包括SAE) |
首次获知后24小时内报告 |
|
SAE(除外致死或危及生命的SUSAR) |
首次获知后24小时内报告 |
|
致死或危及生命的SUSAR |
首次获知后立即报告 |
|
本中心发生的和其他中心发生的 |
报告时限 |
|
非致死或危及生命的SUSAR1 |
尽快报告,但不得超过首次获知后15天。(首次获知当天为第0天) |
|
致死或危及生命的SUSAR1 |
尽快报告,但不得超过首次获知后7天,并在随后的8天内报告、完善随访信息。 |
注1:本中心发生的SUSAR,需要递交本中心SAE首次报告后的补充资料。
3.4 报告
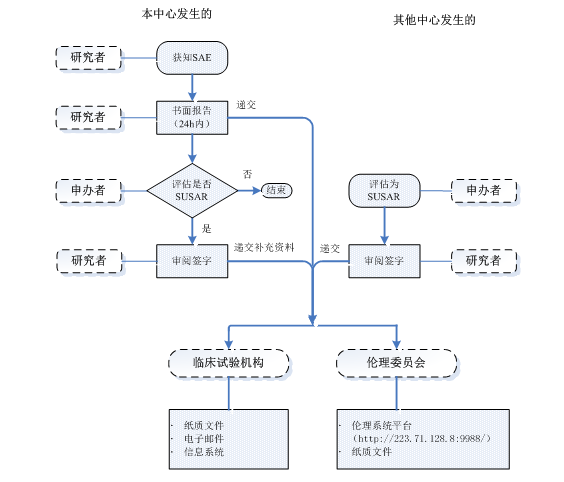
3.4.1 本中心发生3.2所述需要报告的SAE/非预期事件(除外试验方案或者其他文件(如研究者手册)中规定不需立即报告的SAE),研究者在获知受试者出现 SAE 时,应立即通知本中心主要研究者(PI)、药物临床试验机构办公室SAE专员和申办者;并在24小时内向申办者提供书面报告(除非在研究方案中另有约定);同时按3.3所述时限报告本中心伦理委员会办公室。如果申办者分析评估后确定为SUSAR, 研究者收到后应当及时审阅签字,并向机构办公室和伦理委员会办公室递交本中心SAE首次报告后的补充资料,报告时限按3.3所述。SAE/SUSAR报告流程如下图(含首次、随访、总结报告)。
3.4.2 其他中心发生的可疑且非预期严重不良反应(SUSAR),只要涉及的项目同时在本中心开展,均应快速报告给本中心研究者,研究者及时审阅签署SUSAR报告;研究者(或者申办者)应向本院临床试验机构和伦理委员办公室会递交SUSAR报告,报告时限按3.3所述,所有递交的SUSAR报告均需经研究者审阅签字。SAE/SUSAR报告流程如下图(含首次、随访、总结报告)。
3.4.3 研发期间安全性更新(DSUR)报告,依据申办者工作流程自行拟定。
3.4.4 其余非预期不良事件在年度/定期跟踪审查报告或研究完成报告中向伦理委员会办公室报告。
3.4.5 上市后临床试验中发生的SAE或新的不良事件,应同时报告国家药品不良反应监测中心。
SAE/SUSAR报告流程图:
3.5 伦理委员会审查
3.5.1 伦理委员会受理后,首先确定是否需要召开紧急会议审查,如研究过程中出现重大或严重问题,危及受试者安全的情况,经主任委员决定后,召开紧急会议。
3.5.2 按伦理委员会审查流程进行SAE/非预期事件审查,伦理委员会根据安全性风险严重程度,可能要求研究者和申办者加强风险控制措施,如调整临床试验方案、知情同意书、研究者手册,必要时可要求暂停或者终止临床试验。以上意见伦理委员会办公室除了向研究者传达外,还应向机构办公室、HRPP传达。
3.5.3 伦理委员会应对后续处理情况进行跟踪审查。
4. 名词
4.1不良事件(Adverse Event, AE):病人或临床试验受试者接受一种药品后出现的不良医学事件,但并不一定与治疗有因果关系。
4.2 严重不良事件(Serious Adverse Event, SAE):临床试验过程中发生需住院治疗、延长住院时间、伤残、影响工作能力、危及生命或死亡、导致先天畸形等事件。
4.3 非预期不良事件(Unexpected Adverse Event):不良事件的性质、严重程度或频度,不同于先前方案或其他相关资料(如研究者手册、药品说明)所描述的预期风险。
4.4 预期的严重不良事件(Expected Serious Adverse Event, ESAE):申请人可预见的、在研究中的一般患者人群和某种疾病的患者(或两者兼有)以一定频率发生(不依赖于受试药物的暴露)的严重不良事件。
4.5 药品不良反应(Adverse Drug Reaction, ADR):ICH GCP对于已上市药品和未上市药品有所不同:在一个新的药品或药品的新用途在批准之前的临床实践,尤其是治疗剂量尚未确定前,ADR 是指与药物任何剂量有关的所有有害的和非意求的反应都应被考虑为药物不良反应。该术语用于药品是指在药品与不良反应之间的因果关系至少有一个合理的可能性,即不能排除这种关系;对已上市药品,ADR 仅指对用于预防、诊断或治疗疾病或改善生理功能的药物在常用剂量下出现的有害和非意求反应。
4.6 非预期药品不良反应(Unexpected Adverse Drug Reaction, UADR):指一种药品不良反应,其性质、严重程度或频度,不同于先前方案或其他相关资料(如研究者手册、药品说明)所描述的预期风险。非预期,指一个事件比研究者手册中描述的更特殊、更严重,更特殊如急性肾衰后出现间质性肾炎,更严重如首发为重型肝炎的肝炎。
4.7 可疑且非预期严重不良反应(Suspected Unexpected Serious Adverse Reaction, SUSAR):指临床表现的性质和严重程度超出了试验药物研究者手册、已上市药品的说明书或者产品特性摘要等已有资料信息的可疑并且非预期的严重不良反应。
4.8 重要不良事件(Severe Adverse Event):在用药过程中发生的不良事件和血液学或其他实验室检查明显异常,并且这些不良事件和血液学或其他实验室检查明显异常必须采取针对性的医疗措施才能恢复正常。5.参考依据
《药物临床试验质量管理规范》
6.附件
无。